|
 Nguyễn Minh Nam Nguyễn Minh Nam
 |
Triệu chứng vàng gân lá đã được biết đến từ lâu với những tên gọi khác nhau như “Yellow wilt” ở châu Phi (Ricaud, 1968; Siddiqi, 1969; Rogers, 1970) và “autum decline” ở Brazil (Hughes, 1964) (trích bởi Lockhart và cộng sự, 2000). Triệu chứng này cũng đã được nhận thấy ở Hawaii trong những năm 1980 và sau đó là nhiều nước khác trên khắp thế giới (Comstock và cộng sự, 2002; Izaguirre-Mayoral và cộng sự, 2002; Lockhart và cộng sự, 1996; Lockhart và Cronje, 2000; Vega và cộng sự, 1997; Viswanathan, 2002). Nhưng đến những năm 1980 người ta mới biết rõ về nguyên nhân gây bệnh (Schenck và Hu, 1991; Comstock và cộng sự, 1994). Có hai tác nhân liên quan đến triệu chứng vàng lá trên mía. Một là Sugarcane Yellow Leaf Virus (ScYLV) (Lockhart và cộng sự, 1996; Vega và cộng sự, 1997; Scagliusi và Lockhart, 2000) và tác nhân còn lại là Sugarcane yellows phytoplasma (ScYP) (Cronjé và cộng sự, 1998). Tuy nhiên một vài báo cáo khác chỉ ra rằng triệu chứng tương tự cũng có thể bị gây ra bởi côn trùng, stress sinh lý, thời tiết, một vài phản ứng chống stress và một vài yếu tố vô sinh khác (Bailey và cộng sự, 1996; Matsuoka và Meneghin,1999).
Bệnh vàng gân lá do ScYLV hiện nay được báo cáo là hiện diện ở nhiều nước trên thế giới như Argentina, Australia, Barbados, Brazil, Colombia, Cuba, Dominican Republic, El Salvador, Guadeloupe, Guatemala, Hawaii, India, Iran, Jamaica, Kenya, Martinique, Mexico, Morocco, Mozambique, Nicaragua, Peru, Réunion, Senegal, Nam Phi, Swaziland, Thailand, Uganda, Mỹ, Venezuela, Zambia, Zimbabwe, … (Lockhart và cộng sự, 2000) (hình 2.1).
Hình 2.1. Sự phân bố của ScYLV trên thế giới
(Nguồn: Salem Saumtally và cộng sự)
Triệu chứng đặc trưng của bệnh vàng gân lá giống nhau ở tất cả mọi nơi. Gân lá màu vàng tươi, đặc biệt ở trên bề mặt và đỉnh của lá trở nên vàng, sau đó hoại tử. Hoại tử lan rộng xuống bản lá cho tới khi toàn bộ lá bị nhiễm. Thường thì lá non nhất không có biểu hiện triệu chứng, nhưng màu vàng xuất hiện ở những lá thứ tư hoặc thứ năm và những lá già hơn. Những cây non thường không biểu hiện trên đồng ruộng mặc dù những cây non trong nhà kính đôi khi có những triệu chứng đặc trưng dưới những điều kiện stress (Schenck, 2001). Trong một vài trường hợp thì mặt dưới của gân lá trở nên vàng hơn lá già. Mặt trên của gân lá có thể vẫn giữ màu bình thường (trắng hoặc trắng hơi xanh) hoặc có thể trở vàng, hồng hay hơi đỏ. Sự đổi màu của gân lá thường xảy ra trong khi bản lá vẫn giữ màu xanh. Ở một số giống màu vàng của lá có thể ảnh hưởng tới toàn bộ lá. Sự thay đổi sang màu vàng cũng có thể lan rộng ra bản lá và hoại tử bắt đầu từ chóp lá phát triển tới bản lá. Triệu chứng này thường tạm thời và nhạt dần khi cây bắt đầu được chăm sóc tốt.
Sự biểu hiện triệu chứng vàng gân lá trên mía rõ ràng hơn ở những cây trưởng thành và những cây bị stress. Sự biểu hiện triệu chứng liên quan đến giống, nhiệt độ lạnh hoặc yếu tố stress khác và cây bị nhiễm trên đồng thường không có biểu hiện triệu chứng (Schenck và cộng sự, 2001).
Đối với những cây có triệu chứng YLS thì brix cao hơn từ 2 đến 3 lần so với những cây khỏe mạnh. Vega và cộng sự (1997) đã nhận thấy sự tích lũy fenola trong mạch libe, điều đó chứng tỏ có sự rối loạn chức năng của mạch dẫn. Ở những vùng lá khác nhau thì sự giảm tổng lượng đường, hàm lượng chlorophyl và sự vận chuyển đường đã được nhận thấy giữa cây có triệu chứng và cây không có triệu chứng nhiễm với virus ScYLV.
Sugarcane yellow leaf virus là một virus mới được mô tả gần đây, nó nhiễm vào mía và gây ra triệu chứng vàng gân lá (YLS) (Vega và cộng sự, 1997; Scagliusi và Lockhart, 2000).
Hạt virus ScYLV có đường kính từ 24-29 nm trong sodium phosphatungstate ở pH5 (hình 2.2). Nó có tỉ trọng là 1,30g/cm3 trong Cs2SO4 và chứa 5,8 kb ssRNA. Protein vỏ có trọng lượng 27 kDa và không chứa glycosylate. (Scagliusi và Lockhart, 2000).
Hình 2.2. Sugarcane yellow leaf virus dưới kính
hiển vi điện tử (24-28nm), tỉ lệ thước 100nm.
(Nguồn: Scagliusi và Lockhart, 2000)
Kháng huyết thanh từ barley yellow dwarf lueovirus (BYDV) kiểu huyết thanh (serotype) PAV, MAV và RPV đã được kiểm tra cho phản ứng huyết thanh với mô mía bị nhiễm ScYLV (Vega và cộng sự, 1997). Kết quả cho thấy có mối quan hệ huyết thanh học giữa BYDV-PAV và ScYLV. Bằng việc in những vết cắt mô gân lá lên màng nitrocellulose và xử lý chúng với huyết thanh miễn dịch BYDV-PAV, phản ứng miễn dịch dương tính đã được nhận thấy trong những tế bào libe của những bó mạch (Vega và cộng sự, 1997). Kết quả dương tính chỉ nhận thấy ở những cây bị nhiễm với ScYLV, nhưng không bao giờ thấy ở những cây khỏe mạnh được trồng bằng hạt trong nhà kính. Huyết thanh miễn dịch đặc hiệu cho ScYLV được Lockhart nghiên cứu từ virus đã được tinh sạch (Scagliusi và Lockhart, 2000). Hiện nay nó đã được sản xuất thành công từ những mẫu ở nhiều nơi để phát hiện ScYLV bằng cả kỹ thuật ELISA và TBIA (Schenck, 2001).
Quá trình thử truyền mầm bệnh từ dịch trích của cây mía bị nhiễm với ScYLV vào cây khỏe mạnh và các cây thảo mộc khác thì không thành công (Borth và cộng sự, 1994; Lockhart và cộng sự, 1996 (trích bởi Schenck, 2001); Scagliusi và Lockhart, 2000). Một vài loài rệp ở trên mía đã được kiểm tra khả năng truyền virus và kết quả là rệp mía Melanaphis sacchari và rệp lá bắp Rhopalosiphum maidis (hình 2.3) là vector của ScYLV trong khi rệp vàng lá mía thì không (Angel và cộng sự, 2006; Scagliusi và Lockhart, 2000; Schenck và Lehrer, 2000). Virus này không bị truyền bởi những hạt thuần hay bởi phương tiện cơ giới mà chỉ có thể lan rộng trên cánh đồng bởi hạt của những cây đã bị nhiễm hoặc bởi những vector (Schenck và cộng sự, 2001).
Con rệp bắp (Rhopalosiphum maidis) thường ở trên cây bắp và nó ít khi phá hoại trên cây mía. Theo Schenck và cộng sự (2001) rệp này cũng truyền ScYLV ở tỷ lệ thấp. Rệp ở rễ cây lúa (Rhopalosiphum rufiabdomilanis) đã truyền ScYLV từ cây lúa bị nhiễm ScYLV sang cây lúa không bị nhiễm nhưng không truyền virus từ mía sang mía (Schenck và cộng sự, 2001).
Hình 2.3. Rệp lá bắp. Rệp có cánh (A,B), rệp không cánh (C) trưởng thành.
(Nguồn: http//:ipm_ncsu_edu-AG295-pics-corn_leaf_aphid_gif.htm)
Ở Lousiana thời gian gia tăng nhanh nhất của ScYLV xảy ra vào cuối mùa thu và đầu mùa hè cùng với sự gia tăng và bắt đầu tàn phá của loài rệp mía Melanaphis sacchari (McAllister và cộng sự, 2006)
Ở Hawaii YLS thường xuất hiện nhất vào những tháng mùa hè do stress bởi nước. Ở Florida triệu chứng này biểu hiện do hạn hán, úng nước và lạnh vào mùa đông. Triệu chứng bắt đầu xuất hiện với những gân lá từ thứ 3 đến thứ 6 (tính từ ngọn xuống) trở nên vàng khi thời tiết bắt đầu trở lạnh vào tháng 10 và 11. Sau đó màu vàng lan ra bản lá và hoại tử bắt đầu từ đỉnh lá lan ra bản lá vào tháng 12 cho đến cuối mùa thu hoạch vào tháng 3. Từ tháng 1 đến tháng 3 toàn bộ cánh đồng trở thành màu vàng (Comstock và Miller, 2003). Borg (1997) đã báo cáo rằng YLS hiện diện rõ ràng nhất suốt những tháng lạnh ở Australia và cũng tương tự ở Brazil.
Các cây bắp, lúa, lúa mì, lúa mạch, yến mạch được lây nhiễm với ScYLV qua rệp được kiểm tra như là những kí chủ khác của ScYLV. Những cây này được trồng từ hạt trong các chậu và được chủng với những rệp mía có mang virus. Kết quả cho thấy các cây đều có thể bị nhiễm virus (lúa mì (wheat) 96,5%, yến mạch (oat) 94,6%, lúa mạch (barley) 93,7%) nhưng chỉ có một tỉ lệ thấp của cây lúa và bắp được kiểm tra là dương tính (lúa (rice) 8,5%, bắp (corn) 10,5%) (Schenck và cộng sự, 2001).
Dựa trên những phân tích trình tự nucleotide, ScYLV được xếp là một giống mới trong họ luteoviridae. Virus này cũng có những đặc tính của giống polerovirus, luteovirus và enamovirus (Moonan và cộng sự, 2000; Smith và cộng sự, 2000). Tuy nhiên, nó được mô tả rõ ràng là một loài khác vì những đặc tính sinh học độc nhất và sự khác biệt ở mức độ phân tử mà nó được xem là sự tái tổ hợp giữa các loài khác nhau (Moonan và cộng sự, 2000; Smith và cộng sự, 2000).
Dựa vào trình tự và sự sắp xếp của các khung đọc mở (ORF), luteovirus được chia thành hai nhóm phụ (subgroups I và II). Trình tự bộ gene của ScYLV đã được chứng minh là thuộc bộ gene của nhóm phụ II (hình 2.4).
Hình 2.4. Biểu đồ mô tả bộ gene của luteovirus thuộc nhóm phụ I và II
(Nguồn: Schenck, 2001)
Trình tự nucleotide hoàn chỉnh của bộ gene ScYLV được phân lập từ Ấn Độ đã được xác định. Bộ gene RNA này dài 5899 nucleotide bao gồm 6 khung đọc mở (ORF):
ORF1 (72,5 kDa): mã hóa cho protein đa chức năng.
ORF2 (64.4 kDa): mã hóa cho RNA polymerase không phụ thuộc RNA (RdRp).
ORF3 (21.8 kDa): mã hóa cho protein vỏ (CP).
ORF 4 (16.6 kDa): mã hóa cho protein di chuyển giả định p17.
ORF5 (52.1 kDa): mã hóa cho yếu tố truyền aphid giả định.
ORF0: chức năng chưa biết.
Sự so sánh protein vỏ và trình tự 17kDa cho thấy ScYLV có quan hệ gần với virus trong giống luteovirus. Dựa trên trình tự ở đầu 5’ của ScYLV thì thấy nó tương tự với giống polerovirus, trong khi trình tự ở đầu 3’ thì gần với giống luteovirus. Đây là những mô tả đầu tiên về đặc điểm phân tử của ScYLV ở Ấn Độ (Gaur và cộng sự, 2003).
Moonan và cộng sự (2000) đã giải trình tự bộ gene ScYLV. Dựa trên trình tự nucleotide mới của ScYLV và trình tự của luteovirus hiện tại, đồng thời sử dụng phương pháp luận tiến hóa và phát sinh chủng loài để tìm vùng tương đồng của bộ gene luteovirus. Kết quả cho thấy tỷ lệ thay thế các nucleotide và tạo ra loài mới của luteovirus là có ý nghĩa về phương diện thống kê. Kết quả cũng chỉ ra rằng Pea enation mosaic virus-1 (PEMV-1), Soybean dwarf virus (SbDV), và ScYLV biểu hiện biến dị phát sinh chủng loài địa lý (spatial phylogenetic variation (SPV)) phù hợp với sự tái tổ hợp xảy ra giữa hai tổ tiên là luteovirus và polerovirus sau khi có sự phân li di truyền của hai nhóm tổ tiên này.
Toàn bộ trình tự RNA gồm 5895 nucleotide của ScYLV được phân lập từ Florida (ScYLV-F) đã được giải trình tự bao gồm 6 ORF (Smith và cộng sự, 2000). Kết quả cho thấy, đầu 5’ thuộc vùng không dịch mã (UTR, untranslated region) bắt đầu với trình tự ACAAAA thì phù hợp với motif ở đầu 5’ của polerovirus. Bộ gene của ScYLV-F được sắp xếp giống như ở poleovirus.
ORF0 của ScYLV-F bắt đầu ở codon AUG thứ nhất trong trình tự và nó mã hóa cho một protein 30,2 kDa.
ORF1 của ScYLV-F mã hóa cho một protein 72,5 kDa tương tự với gene tương đương ở trên bộ gene của polerovirus và Pea enation mosaic virus-1 (PEMV-1; enamovirus) cũng mã hóa cho một protease.
ORF2 của SCYLV-F hầu như tương đồng với những gene RNA polymerase không phụ thuộc RNA (RNA dependent RNA polymerase (RdRp)) của poleroviruses sobemoviruses, barnaviruses và PEMV-1. Đầu 5’ của ScYLV-F RdRp overlap trên khung đọc 1 ở nucleotide 460. Có một trình tự heptamer, 5’GGGAAAC3’ ở trên overlap ở vị trí 1753 và trình tự ở đầu 3’ của motif heptamer có thể là ở dạng kẹp tóc (pseudoknot) (hình 2.5). Các trình tự này ở trên overlap của ORF 1 và 2 thì được bảo tồn trên bộ gene của polerovirus và PEMV-1 và cho phép khung đọc dịch chuyển ribosomal 1 từ gene ORF1 đến gene RdRP. Heptamer và pseudoknot có thể là có cùng vai trò trong bộ gene của ScYLV-F và vì thế mà ORF 1 và 2 của ScYLV-F có thể được dịch mã liền nhau, sự dịch chuyển khung đọc tạo ra protein dung hợp (fusion protein) 120,6 kDa.
ORF3 hầu như tương đồng với gene mã hóa protein vỏ (CP; 22 kDa) của BYDV-PAV.
Tương tự ORF4 cũng tương đồng với gene mã hóa protein vận chuyển (MP) (Smith và cộng sự, 2000) của BYDV-PAV. Cũng như trên bộ gene của các luterovirid khác, gene mã hóa protein vận chuyển (ORF4) nằm hoàn toàn trong trình tự mã hóa ORF3, trong khung đọc 1. Đầu N của protein vỏ (CP) (ORF3) của ScYLV-F thì giàu arginine và gene CP của ScYLV-F kết thúc với một đột biến vô nghĩa, giống như tất cả các gene CP ở các luteovirid khác và codon này được theo sau bởi codon đầu tiên của gene mã hóa protein RT (read-through, đọc xuyên: kiểu phiên mã di truyền mà việc tổng hợp RNA của một operon lại bắt đầu từ khởi điểm operon khác) (ORF5). Trình tự quanh vùng đột biến vô nghĩa được bảo tồn cao (Smith và cộng sự, 2000).
Hình 2.5. Cấu trúc kẹp tóc giả định trong bộ gene của ScYLV
(Nguồn: Smith và cộng sự, 2000)
ORF0 của ScYLV mã hóa cho protein 30kDa có ít amino acid tương đồng với các protein P0 của những polerovirus khác. Trong 3 protein P0 của polerovirus (PLRV, BWYV và CABYV) ảnh hưởng đến sự tích lũy của virus cũng như sự kìm hãm của posttranscriptional gene silencing (PTGS). Sử dụng Nicotiana benthamiana với cấu trúc GFP reporter, protein P0, và PTGS, Albert và cộng sự (2006) đã chỉ ra rằng protein P0 của SCYLV cũng im lặng ở vị trí PTGS bị gây ra bởi cấu trúc sense GFP (sGFP). Không giống như protein P0 của BWYV, PLRV và CABYV, protein P0 của SCYLV ức chế ảnh hưởng của PTGS bởi sGFP nhưng nó không được gây ra bởi cấu trúc inverted repeat GFP (irGFP). Phân tích chức năng protein P0 bằng cách xóa bỏ cấu trúc P0 của SCYLV cho thấy protein này có nhiều vùng cần thiết cho chức năng ức chế của protein này. Thấm lá với protein P0 của SCYLV, kết quả là xuất hiện những vết hoại tử ở trên những đốm được thấm, sự hủy bỏ hoạt tính ức chế cũng mất đi sự hoại tử, điều đó chứng tỏ những hoạt tính này có thể được liên kết.
Những nghiên cứu về đa dạng di truyền gần đây đã thừa nhận sự tồn tại một vài kiểu gene của ScYLV. Để xác định và mô tả chính xác các kiểu gene của ScYLV, Abu và cộng sự (2006) đã giải trình tự toàn bộ bộ gene (gồm 6 ORF) của 8 ScYLV phân lập từ 6 vùng khác nhau (Brazil, China, Colombia, Cuba, Peru, và Reunion). Bốn kiểu gene của ScYLV (BRA ở Brazil, CUB ở Cuba, PER ở Peru và REU ở Reunion) đã được phát hiện dựa vào phân tích phát sinh chủng loài với trình tự bộ gene của 6 vùng này. Những cặp primer đặc hiệu đã được thiết kế để phát hiện từng kiểu gene của ScYLV bằng RT-PCR. Kết quả cho thấy một vài kiểu gene của ScYLV có thể cùng tồn tại trên một vùng địa lý hoặc trên cùng một cây (Ahmad và cộng sự, 2006).
ScYLV là một tác nhân gây bệnh quan trọng về kinh tế ở Cauca Valley, Colombia. Trong năm 2004, tỉ lệ nhiễm virus này trên toàn bộ cánh đồng trồng mía nguyên liệu là 12,2% (Angel và cộng sự, 2006). Ở Brazil virus này đã nhiễm 25% trên giống SP 71-6163 và 750 000 ha trên toàn bộ diện tích trồng mía (Vega và cộng sự, 1997). Giống SP 71-6163 mẫn cảm cao với ScYLV, ước tính làm mất 40-60% lượng đường (Lockhart và cộng sự, 1996). ScYLV đã hiện diện trên toàn bộ các cánh đồng mía công nghiệp ở Lousiana (McAllister và cộng sự, 2006). Năng suất giảm 15 đến 20% cũng đã được báo cáo do ScYLV ở Louisiana (Grisham và cộng sự, 2002). Sự giảm năng suất (lượng đường trên đơn vị diện tích) ở giống LCP 82-89 cao nhất ở vụ gốc thứ hai là 23% (Grisham). Ở Florida có ít nhất 65% diện tích trồng mía thương mại bị nhiễm với ScYLV (Irey và cộng sự, 1997; ). Ở Nam Phi và Hawaii ảnh hưởng của YLS trên mía đã làm giảm đáng kể hàm lượng phức hợp polysaccharide (gums) được tách chiết (Lockhart và cộng sự, 2000).
Marker phân tử liên kết với tính kháng đã được sử dụng để chọn lọc kiểu gene của những cá thể và có thể cung cấp công cụ để xác định tính kháng ở trên mía. Mục tiêu là tìm những quần thể có những cá thể kháng lại bệnh vàng lá. Kết quả là tìm thấy 39 dòng trong quần thể lai Green German x Ind 81-146 là không có bệnh SCYLV trong suốt quá trình thí nghiệm (Comstock và cộng sự, 2005).
Comstock và cộng sự (2006) đã nghiên cứu về marker phân tử liên kết với tính kháng bằng cách sử dụng microsatellite primer. Mục đích là phát triển phương pháp xác định các dòng kháng với ScYLV một cách nhanh chóng và chính xác. Với 216 microsatellite primer đã xác định được 12 cây nhiễm và 11 cây kháng từ quần thể 65 cây con lai từ Green German (nhiễm) và IND 81-146 (kháng). Trong số 216 microsatellite primer có 167 primer cho ra ít nhất 4 band. Kết quả đã chỉ ra rằng có 3 band đa hình microsatellite liên kết với tính kháng ScYLV. Phân tích kiểu gene trên 47 cây con cho thấy có 2 loci SSR liên kết với tính kháng nhưng không liên kết với locus SSR khác.
Trên một vài giống mía có khả năng kháng lại với ScYLV và tính kháng này có thể di truyền được (Schenck và Lehrer,2001). Những nghiên cứu về tính kháng trên mía đã chỉ ra rằng các giống CC 84-75, CC 87-505, PR 61-632 mẫn cảm với ScYLV, nhưng giống CC85-92 thì kháng tốt với ScYLV (Angel và cộng sự, 2006). Ở Hawaii các giống H 78-4153, H 78-3567, H 78-7750 và H87-4319 được báo cáo là kháng với ScYLV (Schenck và Lehrer,2000).
Các giống mía mới, Saccharum officinarum ít mẫn cảm (như là S. robustum. Saccharum spontaneum, S. sinensisvà Erianthus sp.) thường không có virus ở trên cánh đồng mía ở Maunawili, nó được cho là liên quan đến tính kháng (Schenck và cộng sự, 2001).
Giống mía kháng ScYLV có thể được tạo ra thông qua biến nạp. Sự bất hoạt gene được coi như một cơ chế phổ biến cho sự kháng của cây trồng đối với sự nhiễm của virus. Bất hoạt gene sau sao mã (posttranscriptional gene) đã được hướng tới trong cây mía bởi biến nạp với vùng không giải mã của ScYLV. Bộ gene của ScYLV và chức năng các protein của virus đã được biết đến (F. Moonan, 2000), vì thế chiến lược tạo ra cây mía kháng ScYLV có thể dễ dàng.
Giống H62-4671 đã được biến nạp với một vùng trình tự DNA không dịch mã (non-traslatabe DNA sequence piece) của protein vỏ virus mà nó làm bất hoạt gene RNA của virus để chống lại sự nhiễm virus. Mía có một hệ thống bất hoạt gene rất hữu hiệu (Y. J. Zhu, 2003).
Phôi phát sinh từ mô sẹo của giống lai CC 84-75 được bắn với plasmids pFM395 và pFM396 chứa một đoạn DNA mã hóa protein vỏ của ScYLV. Những cây đã biến nạp được ủ với ScYLV bởi Melanaphis sacchari. Sự nhiễm được kiểm tra sau một vài tháng bằng kỹ thuật TBIA và RT-PCR. Kết quả thu được 37 cây từ 66 cây được kiểm tra là âm tính với ScYLV (Rangel và cộng sự, 2005).
Có 3 phương pháp để loại bỏ virus được sử dụng là xử lý nhiệt, nuôi cấy mô, xử lý bằng hóa chất. Tuy nhiên, xử lý nhiệt và hóa chất thì không có hiệu quả trong việc loại bỏ virus ScYLV (M. Chatenet và cộng sự, 2001). Có thể tạo cây sạch ScYLV bằng phương pháp nuôi cấy mô (M. Chatenetvà cộng sự, 2001; Y. Parmessurvà cộng sự, 2002). Nuôi cấy đỉnh sinh trưởng là phương pháp hiệu quả nhất trong việc sản xuất cây sạch virus và cũng là phương pháp được chọn để loại bỏ virus khỏi cây bị nhiễm. Nuôi cấy đỉnh sinh trưởng có thể tạo ra 92% cây sạch virus, nhưng chỉ đạt 29% khi nuôi cấy bằng chồi đỉnh (M. Chatenetvà cộng sự, 2001). Tuy nhiên, theo Parmessur (2002) khi nuôi cấy đỉnh sinh trưởng chỉ tạo ra 64% cây sạch virus, chỉ có 6% khi nuôi cấy bằng chồi nách. Nhưng khi nuôi cấy từ mô sẹo sẽ tạo ra 100% cây sạch virus.
Triệu chứng bên ngoài: Các triệu chứng phổ biến là đốt cuối ngắn, vàng những lá cuối, mặt dưới của gân lá trở nên vàng hơn lá già, hoại tử bắt đầu từ chóp lá, …
Triệu chứng bên trong: Sự thay đổi tế bào và mô có thể quan sát qua kính hiển vi quang học hay kính hiển vi điện tử. Người ta còn quan sát những cấu trúc khác nhau do virus sản sinh ra, thường là những thể vùi.
Độ brix được đánh giá vào giai đoạn mía 10 tháng tuổi bằng Brix kế trên gân chính lá +1 và được chia thành 4 mức độ nhiễm bệnh khác nhau:
Không bị bệnh: không có triệu chứng, độ brix nhỏ hơn 7.
Nhiễm nhẹ: độ brix từ 7 đến 14.
Nhiễm trung bình: Nhìn mặt trên và mặt dưới lá có màu vàng, độ brix lớn hơn 14, phiến lá có màu vàng lan ra từ gân chính.
Nhiễm nặng: toàn bộ phiến lá và gân lá chính có màu vàng, triệu chứng khô từ cổ lá xuống bẹ lá, toàn bộ cây trong bụi có triệu chứng bệnh, độ brix lớn hơn 14, bụi có thể nhổ lên dễ dàng (Hà Đình Tuấn, 2004).
Những lát cắt tươi được cắt từ gân, bẹ lá và thân bởi dao lam được làm tiêu bản trên một giọt nước cất hai lần trên lam kính và được quan sát dưới kính hiển vi quang học. Toàn bộ mô được nghiên cứu với sự chuyển từ ánh sáng trắng sang ánh sáng xanh bởi đèn huỳnh quang. Sự kiểm tra huỳnh quang với ánh sáng kích thích màu xanh được tiến hành thông qua một kính tách màu nhị sắc ở bước sóng 510nm và một kính lọc màu vàng chặn lại tại bước sóng 510nm.
Hình 2.6. Các bó mạch gân lá được kiểm tra bởi kính hiển vi huỳnh quang. (A) Chất huỳnh quang màu vàng xanh (đầu mũi tên) trong mạch libe với triệu chứng vàng gân lá. (B) Cây không có triệu chứng các bó mạch libe bình thường (J. Vega và cộng sự, 1997).
Kiểm tra những lát cắt từ cây có triệu chứng vàng gân lá bởi phương pháp phát huỳnh quang đã phát hiện ra những bó mạch với chất phát huỳnh quang màu vàng xanh ở trong mạch libe (hình 2.6 A). Trong những cây không có biểu hiện triệu chứng thì hiếm khi xuất hiện màu huỳnh quang trong mạch libe (hình 2.6 B).
Những lát cắt cực mỏng từ lá, gân hoặc thân mía sau khi sử lý bằng hóa chất được quan sát dưới kính hiển vi điện tử.
Virus được tìm thấy ở dạng kết tụ vô định hình trong tế bào chất của tế bào kèm của mạch libe. Trong tế bào kèm, virus chỉ xuất hiện ở tế bào chất không thấy ở trong nhân hay các cơ quan tử khác của tế bào chất. Đường kính của hạt virus từ 22 đến 24 nm
.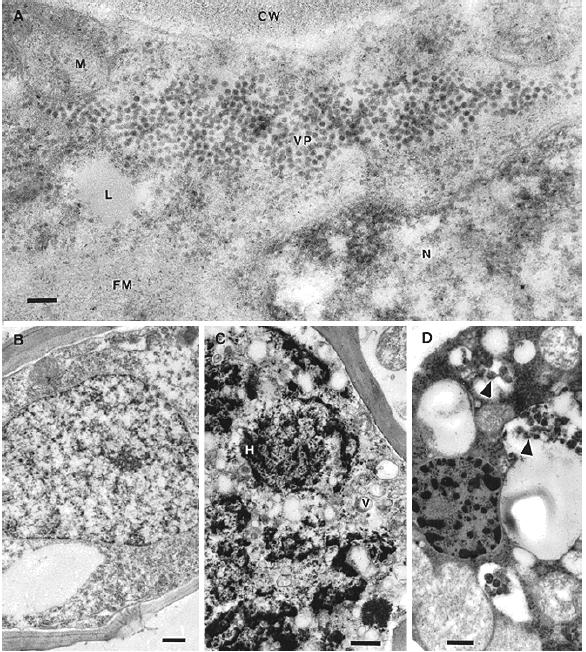
Hình 2.7. Vi ảnh điện tử của lát cắt siêu mỏng của tế bào kèm libe cây mía
(VP: virus particles, CW: cell wall, N: nucleus, tỷ lệ thước 100nm).
(Nguồn: Vega, 1997)
Kháng nguyên thu được (hạt virus tinh sạch) sẽ được tiêm vào thỏ New Zeland để thu globulin miễn dịch. Kháng thể sau khi sản xuất sẽ được sử dụng cho DBIA, TBIA, ISEM để phát hiện các mô bị nhiễm ScYLV (Angel và cộng sự, 2006).
DAS-ELISA được thực hiện trên kháng nguyên từ lá mía và dịch nước mía cho thấy kháng nguyên từ dịch nước mía có chuẩn độ cao hơn kháng nguyên từ lá mía (R Viswanathan và M Balamuralikrishnan, 2004).
1.7.6 Phương pháp chẩn đoán bằng tissue blot immunoassay (TIBA)
Cũng giống như ELISA, TIBA sử dụng kháng thể chống lại virus. Nhựa từ cây được chuyển lên một màng nylone hay nitrocellulose và virus được phát hiện nhờ vào mẫu dò được đánh dấu. Quy trình này không cần nhiều thao tác như ELISA, nhanh, nhạy, đơn giản (không cần dịch chiết của virus), không đắt tiền (chỉ cần số lượng trang thiết bị tối thiểu), thích hợp cho khảo sát 1000 - 2000 mẫu trên ngày. Kit cũng đã sẵn có cho nhiều virus.
Hình 2.8. Kết quả TIBA của vết in gân lá khỏe (trên) và lá bị nhiễm (dưới)
(Comstock và Gilbert)
Sự nhiễm ScYLV được xác định bằng một kháng thể đặc hiệu cho ScYLV. Lá được cắt khỏi cây và bản lá được cắt khỏi gân lá trong một thời gian ngắn. Vị trí gốc của gân lá được cắt bằng dao mỏng. Miếng cắt gân lá được cố định trên màng nitrocellulose. Sau đó màng được rửa với huyết thanh sử dụng kháng thể đặc hiệu cho ScYLV được tạo ra bởi B. E. Lockhart, Đại học Minnesota (Minneapolis) (theo Comstock và Miller (2003)). Sau đó được phủ bởi cơ chất tạo màu. Kính hiển vi ba chiều được dùng để kiểm tra vết lá in. Vì ScYLV được xác định ở trong mạch libe nên mẫu dương tính cho sự hiện diện của virus khi những bó mạch libe trong vết lá in có màu xanh (Comstock và Miller, 2003) (hình 2.8 và 2.9).
Hình 2.9. Màng nitrocellulose được xử lý bằng kỹ thuật TBIA với huyết thanh
của BYDV-PAV. Kết tủa xuất hiện ở mạch libe của gân lá (A và B), lá (C),
thân (D). Tỷ lệ thước 200µm. (Nguồn: Vega, 1997)
1.7.7 Chẩn đoán ScYLV bằng kỹ thuật Immunoblotting (western blotting)
Sau khi điện di protein trên SDS-PAGE, polypeptides được chuyển lên màng nitrocellulose để thực hiện Immunoblotting (western blotting). Màng được ngâm 2 phút trong 2% Tween 20 (v/v) và ủ qua đêm ở 40C với kháng thể sơ cấp (toàn bộ huyết thanh) được pha loãng với tỉ lệ 1:5000 trong TTBS chứa 1% gelatin. Những band protein được phát hiện dựa vào 5-bromo-4-chloro-3-indolyl phosphate và nitroblue tetrazolium (BCIP/NBT). Hạt virus ScYLV chứa protein 27 kDa, là một polypeptide được xác định bằng cách nhuộm với Coomassie blue (hình 2.11A). Protein 58, 27 và 17 kDA (6 band) được xác định bằng western blotting với kháng huyết thanh ScYLV (hình 2.11,lane1).
Hình 2.10. Kết quả immunoblotting (westren blotting) của protein ScYLV
(Nguồn: Scagliusi và Lockhart, 2000)
Sử dụng phân tử beacon (Tyagi và Kramer, 1996; Eun và Wong, 2000) trong chẩn đoán virus cho phép phát hiện nhanh, nhạy và đặc hiệu hơn các kỹ thuật khác. Kết hợp kỹ thuật phân tử beacon với sự khuếch đại dựa trên trình tự acid nucleotide (NASBA: nucleic acid sequence-based amplification, Kievits và cộng sự, 1991) cho phép đồng thời khuếch đại và phát hiện RNA của virus trong một tube kín, được gọi là AmpliDet RNA (Leonevà cộng sự, 1998). NASBA là phương pháp khuếch đại RNA đích của virus trong điều kiện đẳng nhiệt ở 410C sử dụng hai oligonucleotide primer đặc hiệu và enzyme AMV-reverse transcriptase (AMV-RT), RNase H và T7-RNA polymerase. Gần đây, AmpliDet RNA đã được sử dụng để xác định một số virus thực vật (Klerks và cộng sự, 2001; Leone và cộng sự, 1998; Szemes và cộng sự, 2002). AmpliDet RNA có độ nhạy cao và ổn định cho việc phát hiện những virus ở trong mô cây phức tạp như vỏ, chồi, củ và quả. Hơn nữa, AmpliDet RNA phát hiện được đồng thời nhiều virus riêng biệt trong cùng một tube (Klerks và cộng sự, 2001; Szemes và cộng sự, 2002).
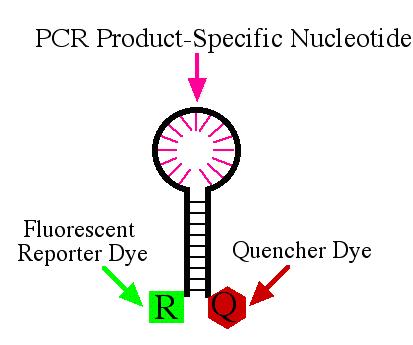 Hình 2.11. Phân tử Beacon
(Nguồn: http://www.molecular-beacons.org)
Phân tử beacon MB ScYLV được thiết kế để mang trình tự 6 nucleotide tự bổ sung với nhau ở đầu 5’ và đầu 3’. Trình tự 21 nucleoitde bổ sung cho sản phẩm NASBA đặc hiệu cho ScYLV được chọn để lai với vùng tương tự như biotinylated probe BIO ScYLV. Phân tử beacon được kết hợp với 6-carboxyfluorescein (FAM; bị kích thích ở bước sóng 494 nm, phát sáng ở bước sóng 530 nm) và quencher 4-[4 -dimethylaminophenylazo]-benzoic acid (DABCYL) riêng biệt ở đầu 5’ và 3’. Đầu 6 nucleotide cấu trúc sợi đôi ở 410C sẽ kìm hãm sự phát quang khi không có sự bắt cặp với trình tự đích. Khi có mặt gene đích probe sẽ bắt cặp với gene đích đồng thời với sự phát huỳnh quang. Tín hiệu huỳnh quang được đo ở bước sóng 530nm sau mỗi 2 phút.
Phương pháp này có độ nhạy cao với ScYLV, có thể phát hiện ScYLV ở mật độ rất nhỏ 10fg (femtogram, 1fg = 10-15g). Phương pháp cho phép phát hiện ScYLV sau khi pha loãng mẫu 1000 lần (Gonçalvesvà cộng sự, 2002).
1.7.9 Chẩn đoán ScYLV bằng kỹ thuật RT-PCR
RT-PCR được thực hiện trên dịch trích mô bị nhiễm ScYLV với cặp primer Lu1 và Lu4 đặc hiệu cho nhóm virus luteovirus (Irey và cộng sự, 1997). Cặp primer Lu1 và Lu4 tạo ra sản phẩm có kích thước 530bp đặc hiệu cho gene mã hóa protein vỏ của virus (Robertson và cộng sự, 1991 (trích bởi Schenck, 2001)). Những primer này được sử dụng để tách trình tự acid nucleotide của ScYLV mà nó được chứng minh rằng có khoảng 40% tương đồng với trình tự PAV của kiểu huyết thanh BYDV. Từ trình tự của ScYLV được phân lập từ Florida, một cặp primer khác đã được tạo ra (YLS111 và YLS462), nó đặc hiệu cho ScYLV (Irey và cộng sự, 1997). Primer này khuếch đại gene mã hóa cho protein vỏ của ScYLV. Sản phẩm khuếch đại có kích thước 352bp. Ngày nay cặp primer này được sử dụng để phát hiện ScYLV ở các nơi như Brazil, Colombia, Taiwan, Mauritius và Mexico Florida, Hawaii, (Irey, thông tin cá nhân).
Ngoài ra các cặp primer khác khuếch đại gene mã hóa protein vỏ cũng được sử dụng để phát hiện ScYLV như các cặp primer:
RT-PCR sense primer – P1f GCT AAC CGC TCA CGA AGG AAT GT (3660–3882bp).
RT-PCR antisense primer – P2r GAA GGG GGC CGG GAA GAC T (4091–4109 bp).
RT-PCR sense primer – P3f CAG GTG CAA TCG CAC TTG AAG TGG A (3997–4021bp).
RT-PCR antisense primer – P4r GAA TTG TCC TGC TAG GCT CGA (4179–4199bp).
NASBA sense primer – N2f CAG GTG CAA TCG CAC TTG AAG TGG A (3997–4022bp) (Gonçalvesvà cộng sự, 2002).
Tài liệu tham khảo
1. Hà Đình Tuấn, 2004. Điều tra thành phần bệnh hại mía trên một số giống mía mới nhập nội và khảo sát diễn biến bệnh hại quan trọng ở vùng mía nguyên liệu miền Đông Nam Bộ. Luận văn thạc sĩ ngành nông học đại học Nông Lâm Tp Hồ Chí Minh.
2. AhmadY Abu, M Royer, L Costet, J-H Daugrois, J-M Lett, J.I Victoria and P Rott, 2006. Genotyping of Sugarcane yellow leaf virus in Colombia, Guadeloupe and Reunion. VIIIth ISSCT Pathology Workshop Petit-Bourg, Guadeloupe (FWI) 23 - 27 January 2006 Programme and Abstracts.
3. Henrik H Albert, Tichaona Mangwende, Ming-Li Wang, T. Erik Mirkov, 2003. Functional Analysis Of The P0 Protein Of Sugarcane Yellow Leaf Virus: A Suppressor Of Posttranscriptional Gene Silencing.Plant & Animal Genomes XIV Conference. Workshop: Intl. Consortium for Sugarcane Biotech. (ICSB) January 14-18, 2006. Town & Country Convention Center, San Diego, CA.
4. S. M. Aljanabi, Y. Parmessur, Y. Moutia, S. Saumtally and A. Dookun, 2001. Further evidence of the association of a phytoplasma and a virus with yellow leaf syndrome in sugarcane. Plant Pathology 50, p 628±636.
5. Angel S. J.C, GuzmánR. M. L, Angel S. F, Victoria K. J. I, 2006. Studies on the Sugarcane yellow leaf virus (SCYLV) in Colombia. VIIIth ISSCT Pathology Workshop Petit-Bourg, Guadeloupe (FWI) 23 - 27 January 2006 Programme and Abstracts.
6. Kathryn S. Braithwaite, 2003. New virus and virus – like diseases of sugarcane – an overview. Sugarcane pathology. Volume II: virus and phytoplasma diseases. Sugarcane Pathology: Virus and Phytoplasma Diseases v. 2 (G.P. b, R.E. Ford, M.Tǒsic and D.S. Teakle). Science Publishers, Inc: p 3-24.
7. Chatenet M., Delage C.,. Ripolles M, Irey M., Lockhart B. E. L, and Rott P., 2001. Detection of Sugarcane yellow leaf virus in quarantine and production of virus-free sugarcane by apical meristem culture. Plant Dis. 85: p1177-1180.
8. ComstockJ. C. and. Gilbert R. A. Sugarcane Yellow Leaf Disease. University of Florida, IFAS extension. SS-AGR-256.
9. Comstock J. C. and Miller J. D., 2003. Incidence and spread of sugarcane yellow leaf virus in sugarcane clones in the cp-cultivar development program at Canal Point. Journal American Society of Sugarcane Technologists, Vol. 23, 2003, p71-78.
10. Comstock J. C., Sood S., and McCorkle K., 2005. Characterization of Sugarcane Populations for Disease Reactions for Use in Molecular Marker Research. Agricultural absracts 2005 annual meeting. Journal American Society Sugar Cane Technologists, Vol. 25, 2005. [Abstracts].
11. Comstock J ack C., Chaparro Jose X., Tai Peter Y. P., Serge Edme, Katherine McCorkle, Jim D. Miller, 2004. The Association Of Microsatellite Markers With Resistance To Sugarcane Yellow Leaf Virus. Workshop: Intl. Consortium for Sugarcane Biotech (ICSB). Plant & Animal Genomes XII Conference January 10-14, 2004. Town & Country Convention Center San Diego, CA.
12. Cronjé C.P.R., 2004. Sugarcane viruses in sub-Saharan Africa. Plant virology in sub-Saharan Africa, p 492-497.
13. Cu Ramon, Manjunath K. L.,. Petersen Y,. Hiebert E and Davis M. J., 2004. Development of a Serological Diagnostic Probe to Detect the Sugarcane Yellow Leaf Luteovirus (SCYLV) Using Phage Display Technology. Journal American Society Sugar Cane Technologists, Vol. 24, 2004. [Abstracts].
14. Garcés Freddy, Reyna Medina and Eloy Orellana, 2006. Transmission of Sugarcane yellow leaf virus and Sugarcane mosaic virus in Ecuador. VIIIth ISSCT Pathology WorkshopPetit-Bourg, Guadeloupe (FWI) 23 - 27 January 2006 Programme and Abstracts.
15. Gaur R.K., Rao G.P., Maneesha Singh and Axel T. Lehrer, 2003. Sequence analysis of theentire RNA genome of sugarcane yellow leaf luteovirus of an Indian isolate BSPP Presidential Meeting 2003 (15th – 18th December 2003) Plant Pathogen Genomics - From Sequence To Application Jubilee Campus, University of Nottingham, UK.
16. M.C. Gonçalves, M.M. Klerks,, M. Verbeek, J.Vega and J.F.J.M. van den Heuvel, 2002. The use of molecular beacons combined with NASBA for the sensitive detection of Sugarcane yellow leaf virus. European Journal of Plant Pathology 108: p401–407, 2002. Kluwer Academic Publishers. Printed in the Netherlands.
17. Lockhart Ben E., Cronjié C. Pieter R., Rott P., Bailey Roger A., Comstock Jack C., Barry J. Croft, A. Salem Saumtally, 2000. Yellow leaf syndrome. A guide to sugarcane diseases. CIRAD/ISSCT
18. McAllister C. D., Hoy J. W., and Reagan T. E., 2006. Temporal increase and spatial distribution of yellow leafand sugarcaneaphid infestations VIIIth ISSCT Pathology Workshop Petit-Bourg, Guadeloupe (FWI) 23 - 27 January 2006 Programme and Abstracts.
19. Moonan F., Molina J., and Mirkov T. E., 2000. Sugarcane yellow leaf virus: An emerging virus that has evolved by recombination between luteoviral and poleroviral ancestors. Virology 269: p156-171. Academic Press.
20. Parmessur Y., Aljanabi S., Saumtally S. and Dookun-Saumtally A., 2002. Sugarcane yellow leaf virus and sugarcane yellows phytoplasma: elimination by tissue culture. Plant Pathology. Volume 51 Page 561-566.
21. M. Paola Rangel, Lorena Gomez, Jorge I. Victoria, Fernando Angel, 2005. Transgenic plants of CC 84-75 resistant to the virus associated with the sugarcane yellow leaf disease. Silver jubilee congress Guatemala january 30 - february 4, 2005 abstracts of papers. International Society of Sugar Cane Technology.
22. Rassabya L.,. Girard J.-C, Lemaire O., Costet L., Irey M. S., Kodja H.,. Lockhart B. E. Land Rott P., 2004. Spread of Sugarcane yellow leaf virus in sugarcane plants and fields on the island of Réunion. Plant Pathology. Volume 53 Page 117-125.
23. ScagliusiSandraMansur and Lockhart B. E. L., 2000. Transmission, characterization, and serology of a luteovirus associated with yellow leaf syndrome of sugarcane. Phytopathology 90: p120-124.
24. SchenckS., Lehrer A.T., Wu K.K., 2001. Yellow Leaf Syndrome. Hawaii Agriculture Research Center, Pathology Report 68 February 2001.
25. Schenck Susan, 2001. Sugarcane yellow leaf syndrome: History and current concepts. Sugarcane pathology. Volume II: virus and phytoplasma diseases. Sugarcane Pathology: Virus and Phytoplasma Diseases v. 2 (G.P. Rao, R.E. Ford, M.Tǒsic and D.S. Teakle). Science Publishers, Inc: p24-35.
26. SmithGrant R., Borg Zara, Lockhart Ben E. L., Braithwaite Kathryn S. and Gibbs Mark J., 2000. Sugarcane yellow leaf virus: a novel member of the Luteoviridae that probably arose by inter-species recombination. Journal of General Virology (2000), 81, p1865–1869. Printed in Great Britain.
27. Vega J., Scagliusi S. M. M., Ulian E. C, 1997. Sugarcane yellow leaf disease in Brazil: evidence of the association with a luteovirus. Plant Disease Vol 81No. 1 p21 - 26.
28. Viswanathan R and Balamuralikrishnan M, 2004. Detection of sugarcane yellow leaf virus, the causal agent of yellow leaf syndrome in sugarcane by DAS-ELISA.Archives of Phytopathology and Plant Protection. Volume 37, Number 3 / August 2004, p169 – 176. Publisher: Taylor & Francis.[Abstract].
29. Wang M-L., AnchetaS., Clayton J., Goldstein C. and Albert H., 2003. Production of a biologically active pharmaceutical protein in sugarcane and rice. Hawaii Agriculture Research center Annual report 2003. p.12.
30. ZhuY. J., Osterman G., Moritomo C., McCafferty H., Agabayani R., Lehrer A., Schenck S. andMoore P., 2003. Developing Transgenic Sugarcane for ScYLV Resistance. Hawaii Agriculture Research center Annual report 2003. p. 9.
ĐỊA CHỈ TRÊN WEB
40. http//:ipm_ncsu_edu-AG295-pics-corn_leaf_aphid_gif.htm
Số lần xem trang : 15055
Nhập ngày : 05-03-2009
Điều chỉnh lần cuối : 23-10-2009 Ý kiến của bạn về bài viết này

 Sản xuất taxol từ nấm nội sinh thực vật(14-07-2011) Sản xuất taxol từ nấm nội sinh thực vật(14-07-2011)
 Tam giác Nano bạc bọc chitosan, tiền năng trong điều trị ung thư(27-06-2011) Tam giác Nano bạc bọc chitosan, tiền năng trong điều trị ung thư(27-06-2011)
 Tinh dầu cá và tinh dầu lưu ly có thể giảm viêm và loãng xương(18-06-2011) Tinh dầu cá và tinh dầu lưu ly có thể giảm viêm và loãng xương(18-06-2011)
 Tác dụng chống ung thư gan của Cannabinoids từ cây cần sa (17-06-2011) Tác dụng chống ung thư gan của Cannabinoids từ cây cần sa (17-06-2011)
 Tạo tế bào thần kinh từ tế bào thường(08-06-2011) Tạo tế bào thần kinh từ tế bào thường(08-06-2011)
 Tầm nhìn phát triển vaccine chống HIV, lao và sốt rét tới năm 2020(05-06-2011) Tầm nhìn phát triển vaccine chống HIV, lao và sốt rét tới năm 2020(05-06-2011)
 Các RNA không mã hóa protein: một thế giới rộng lớn và tiềm ẩn(23-05-2011) Các RNA không mã hóa protein: một thế giới rộng lớn và tiềm ẩn(23-05-2011)
 Cách pha primer(01-06-2009) Cách pha primer(01-06-2009)
 Một số bệnh do virus trên cây mía(05-03-2009) Một số bệnh do virus trên cây mía(05-03-2009)
Trang kế tiếp ...
|